Le 21 septembre 2025 marquait le huitième anniversaire des modifications importantes qui ont été apportées au Règlement sur les médicaments brevetés (avis de conformité) (le « Règlement »). Le présent article fait le point sur les activités consignées au cours de la huitième année suivant ces modifications, y compris les nouvelles actions intentées et les décisions rendues par les tribunaux, tant sur le fond que sur la forme. Notre mise à jour du septième anniversaire contient les liens vers les mises à jour des années précédentes.
Statut des actions au titre du paragraphe 6(1) du Règlement
Du 21 septembre 2024 au 20 septembre 2025, environ 23 ensembles* d’actions (24 actions au total) au titre du paragraphe 6(1) ont été entrepris, soit moins qu’au cours des années précédentes (voir le graphique ci-dessous).
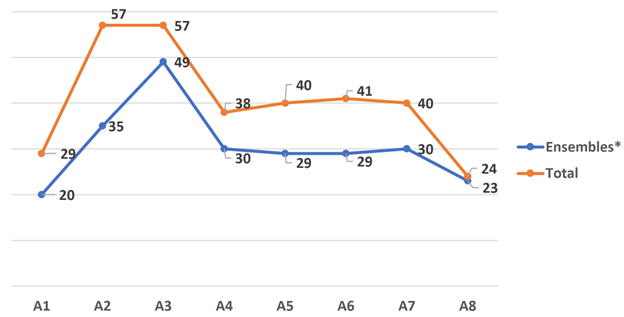
Sur les actions entreprises depuis ces modifications, au nombre approximatif de 326, la majorité (264, présentées en gris ci-dessous) continue de se résoudre avant qu’une décision ne soit rendue sur le fonds à l’égard de la contrefaçon et/ou de l’invalidité (dans presque tous les cas, avant le procès).
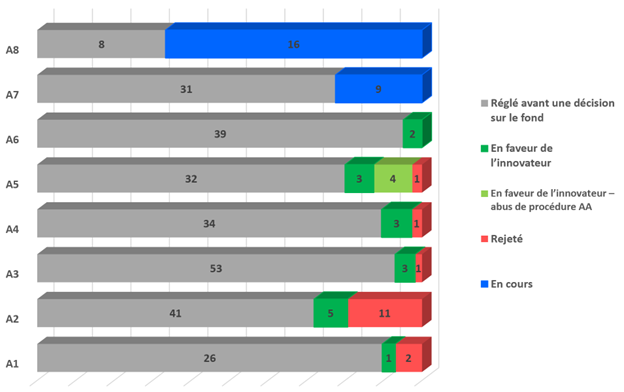
À ce jour, 33 actions ont donné lieu à des décisions sur le fond concernant la contrefaçon et/ou l’invalidité, l’innovateur ayant obtenu gain de cause dans 17 d’entre elles. Au total, 20 décisions ont été rendues sur le fond, dont 13 en faveur de l’innovateur (la Cour a rendu une seule décision pour certaines actions jugées conjointement et a rendu deux décisions, soit une pour la contrefaçon et une pour l’invalidité, dans l’une d’entre elles).
Aucune décision rendue en première instance n’a été infirmée en appel jusqu’à maintenant, et trois appels sont en instance devant la Cour d’appel fédérale. En septembre dernier, la Cour suprême du Canada (CSC) a accordé à Pharmascience la première autorisation d’interjeter appel en vertu du Règlement modifié. Cet appel porte sur la brevetabilité des méthodes de traitement médical, et devrait être entendu le 9 octobre 2025.
Les 19 médicaments suivants font l’objet d’au moins une action en cours :
- apalutamide (ERLEADA de Janssen)
- axitinib (INLYTA de Pfizer)
- bosutinib (BOSULIF de Pfizer)
- calcipotriol (ENSTILAR de Leo Pharma)
- diclofénac (CAMBIA d’Aralez)
- empagliflozine (JARDIANCE de Boehringer)
- empagliflozine/chlorhydrate de metformine (SYNJARDY de Boehringer)
- esoméprazole/naproxène (VIMOVO de Xediton)
- lenvatinib (LENVIMA de Eisai)
- macitentan (OPSUMIT de Janssen)
- chlorhydrate de naloxone (vaporisateur nasal NARCAN d’Emergent)
- olaparib (LYNPARZA d’AstraZeneca)
- pérampanel (FYCOMPA d’Eisai)
- pertuzumab (PERJETA de Hoffmann-La Roche)
- rifaximine (ZAXINE de Salix)
- ruxolitinib (JAKAVI de Novartis)
- tramétinib (MEKINIST de Novartis)
- trifluridine/tipiracil (LONSURF de Taiho)
- vortioxétine (TRINTELLIX de Lundbeck)
Au cours de la dernière année, en termes de nombre de médicaments, Sandoz, Apotex et Auro ont été les parties contestatrices les plus actives, contestant chacune les brevets pour trois médicaments.
Actions au titre de l’article 8.2 : Dans la dernière année, 8 actions ont été intentées au titre de l’article 8.2 (pour un total de 50 actions intentées depuis les modifications apportées au Règlement). L’article 8.2 permet à la première personne/au propriétaire d’un brevet d’intenter une action en contrefaçon à l’égard d’un brevet non visé dès la réception d’un avis d’allégation. Quatre de ces actions sont en cours, et elles concernent l’apalutamide (ERLEADA de Janssen), le diclofénac (CAMBIA d’Aralez), le chlorhydrate de naloxone (vaporisateur nasal NARCAN d’Emergent) et le tramétinib (MEKINIST de Novartis).
Actions au titre de l’article 8.1 : Selon l’article 8.1, une personne qui dépose une présentation pour un avis de conformité, et qui a des motifs raisonnables de croire que la drogue pourrait faire l’objet d’une allégation de contrefaçon d’un brevet, est considérée comme « un intéressé » qui peut intenter une action afin d’obtenir une déclaration d’invalidité du brevet.
Dans la dernière année, aucune action fondée sur l’article 8.1 n’a été intentée. Toutefois, Samsung Bioepis et Amgen ont chacune une action en cours à ce titre visant à obtenir respectivement une déclaration d’invalidité d’un brevet relatif à l’ustekinumab (STELARA de Janssen) et d’un brevet relatif à l’éculizumab (SOLIRIS d’Alexion).
Outre les actions intentées en vertu du Règlement, des procédures relatives à la contrefaçon et/ou à l’invalidation ont également été engagées au cours des 12 derniers mois concernant le sugammadex (BRIDION de Merck), un vaccin contre la COVID-19 (SPIKEVAX de Moderna) et le pembrolizumab (KEYTRUDA de Merck et le produit biosimilaire GME751 de Sandoz).
Décisions sur le fond
Au cours de la huitième année, une seule décision sur le fond a été rendue. Dans celle-ci, la Cour fédérale a accordé à Alexion une déclaration de contrefaçon et une injonction empêchant Amgen de fabriquer, d’utiliser et de vendre son produit à base d’éculizumab, BEKEMV (un produit biosimilaire au SOLIRIS d’Alexion), au Canada jusqu’à l’expiration du brevet 810 d’Alexion. La juge de première instance a conclu qu’Amgen ne s’était pas acquittée du fardeau qui lui incombait d’établir l’antériorité ou l’évidence. La procédure d’appel d’Amgen est en cours.
Autres décisions des tribunaux
La Cour fédérale a rejeté la demande de contrôle judiciaire de Bayer contre la décision du ministre de la Santé d’inscrire un brevet à l’égard d’EYLEA (aflibercept) au registre des brevets huit jours après sa présentation à Santé Canada, et la Cour d’appel fédérale a rejeté l’appel de Bayer. Il s’agissait de la deuxième décision de ce genre; la Cour fédérale a également estimé que la décision du ministre d’inscrire un brevet au registre à l’égard du MAVENCLAD (cladribine) d’EMD Serono n’était pas déraisonnable, car elle avait été prise lorsque le brevet a été jugé admissible, et non lorsqu’il a été présenté. La question du moment est donc importante : dans les deux cas, un fabricant de produit biosimilaire/générique (la seconde personne) a déposé sa présentation réglementaire pendant la période intermédiaire, et la seconde personne n’est pas tenue de tenir compte d’un brevet inscrit au registre des brevets à la date de dépôt de sa présentation ou après celle-ci.
Dans le cadre d’une action intentée au titre du paragraphe 6(1) du Règlement, la Cour fédérale a accueilli la demande d’Amgen, concluant qu’un brevet inscrit à l’égard de l’aflibercept (EYLEA) de Bayer ne satisfaisait pas à l’exigence de spécificité du produit pour être inscrit au titre d’un supplément à une présentation de drogue nouvelle. L’appel interjeté par Bayer contre cette décision a été abandonné à peu près au même moment que l’action, soit en août 2025.
Actions au titre de l’article 8
À ce jour, aucune décision sur le fond concernant l’article 8 modifié n’a été rendue. À l’exception d’une action qui est toujours en instance, toutes les actions antérieures fondées sur l’article 8 ont été abandonnées avant le procès. L’action en instance fondée sur cet article a été entreprise par Pharmascience et concerne la fampridine, et le procès devrait commencer le 2 février 2026.
Si vous avez des questions, n’hésitez pas à communiquer avec un membre du groupe Sciences De La Vie - Réglementation et conformité.
Ce qui précède se veut une mise à jour régulière du droit réglementaire de la propriété intellectuelle et des sciences de la vie au Canada. Le contenu est informatif seulement et ne constitue pas un avis juridique ou professionnel. Pour obtenir de tels conseils, veuillez communiquer directement avec nos bureaux.
Reference
Publications et articles
-
Mise à jour sur le CEPMB : Entrée en vigueur des Lignes directrices pour le personnel du CEPMB le 1er janvier 2026 et Rapport annuel 2024
Le 1er janvier 2026, les Lignes directrices pour le personnel du CEPMB entreront en vigueur. En novembre dernier, le Conseil d’examen du prix des médicaments brevetés (le « CEPMB ») a tenu des séances...Lire la suite -
Les faits saillants de 2025 au Canada en matière de PI en sciences de la vie et de droit réglementaire
En 2025, l’équipe responsable des mises à jour PI Rx chez Smart & Biggar s’est penchée sur un certain nombre de nouveautés en matière de PI en sciences de la vie et de droit réglementaire. Les fai...Lire la suite -
Les 10 articles incontournables de la Mise à jour en PI Rx en 2025
Voici les articles les plus lus de la rubrique Mise à jour en PI Rx en 2025 : Le point sur les biosimilaires au Canada – juin 2025 (en anglais uniquement) Santé Canada do...Lire la suite
